В случае повреждения ядро клетки вызывает антиоксидантные ферменты для восстановления ДНК и сохранения целостности генома. Хотя ранее считалось, что ядро метаболически неактивно, это открытие знаменует собой серьезный сдвиг в нашем понимании молекулярной биологии. Кроме того, исследование обещает новые, потенциально более эффективные стратегии лечения рака.
В случае повреждения ядро клетки вызывает антиоксидантные ферменты для восстановления ДНК и сохранения целостности генома. Хотя ранее считалось, что ядро метаболически неактивно, это открытие знаменует собой серьезное изменение в нашем понимании молекулярной биологии. Более того, это исследование обещает новые и потенциально более эффективные терапевтические стратегии против рака.
Внутри каждой из миллиардов клеток, составляющих наш организм, постоянно происходят химические реакции, превращающие питательные вещества в энергию и различные жизненно важные соединения. Во время этого активного метаболизма образуются побочные продукты реакции («активные формы кислорода» или АФК), которые могут повредить структуру ДНК. Например, перекись водорода, одно из таких соединений, повреждает структуру ДНК точно так же, как вода и кислород разъедают металл и образуют ржавчину. В результате ДНК постоянно подвергается воздействию экзогенных и эндогенных мутагенов.
Для защиты от «окислительного стресса» и сохранения целостности генома клетки систематически запускают каскад механизмов, позволяющих им восстанавливать повреждения ДНК. Этот защитный процесс осуществляется антиоксидантными ферментами, которые разрушают АФК в источнике. В частности, в каждом соответствующем участке хроматина протекает специфическая реакция восстановления. Если повреждение кажется непоправимым, соответствующая клетка активирует сигнал, который позволяет ей временно приостановить свою деятельность, чтобы сосредоточиться исключительно на восстановлении или вступить в апоптоз (запрограммированное самоуничтожение).
Эта стратегия позволяет защитить 3 миллиарда нуклеотидов, составляющих каждую клетку, от потенциально опасных мутаций и инициировать естественные механизмы защиты от различных заболеваний или врожденных аномалий. До сих пор ученые считали, что клетки уравновешивают потребности в энергии и сохраняют геном, ограничивая метаболическую активность вне ядра, особенно в цитоплазме и митохондриях. Поэтому предполагалось, что ядро клетки метаболически неактивно.
Точный способ, которым метаболические нарушения могут вызвать повреждение ДНК и запустить процесс самовосстановления, до сих пор в значительной степени неизвестен.
Обратите внимание: Обновление Windows 10 в октябре приостановлено, оно вызывает слишком много проблем.
Результаты исследования, которые в настоящее время рецензируются и публикуются в журнале , проливают новый свет на этот сложный механизм, раскрывая ранее неопубликованные результаты.Исследователи из Центра геномной регуляции в Барселоне и Медицинского университета Вены обнаружили, что в случае обширного повреждения ДНК ядро защищает себя, приобретая митохондриальный механизм восстановления. Вопреки тому, что считалось ранее, ядро метаболически активно. Учитывая, что опухолевые клетки захватывают нормальный клеточный метаболизм для распространения, результаты исследования дают новые подсказки для разработки более эффективных методов лечения рака.
Ключ к преодолению устойчивости к химиотерапии
Чтобы увидеть, что происходит на уровне клеточного ядра, исследователи вызвали повреждение ДНК в клетках человека in vitro с помощью этопозида, препарата, обычно используемого в химиотерапии. У больных раком лечение направлено на повреждение ДНК раковых клеток путем ингибирования фермента репарации, который должен поддерживать целостность их генома. Когда накапливается достаточно повреждений, клетки начинают процесс апоптоза.
Эксперты были удивлены, обнаружив, что образование повреждений ДНК приводит к накоплению АФК в ядре. Ферменты, участвующие в клеточном дыхании (синтезе энергии из кислорода и питательных веществ), которые являются основными источниками АФК, перемещаются из митохондрий в ядро для восстановления повреждений ДНК в ядре.
«Там, где есть дым, есть огонь, а там, где есть активные формы кислорода, работают метаболические ферменты», — объясняет Сара Сдельчи, автор исследования и глава отдела Центра геномной регуляции в Барселоне. «Наше исследование показывает, что в клетках существует другой тип метаболизма, который находится в ядре», — добавляет она.
Было замечено, что клетки инициируют процесс, который «приказывает» ферменту PRDX1, который обычно секретируется только митохондриями, мигрировать в ядро. Благодаря этому ферменту не только восстанавливались повреждения ДНК, но и улучшалась доступность аспартата (необходимого для синтеза нуклеотидов). Это первое наблюдение этого процесса на ядерном уровне.
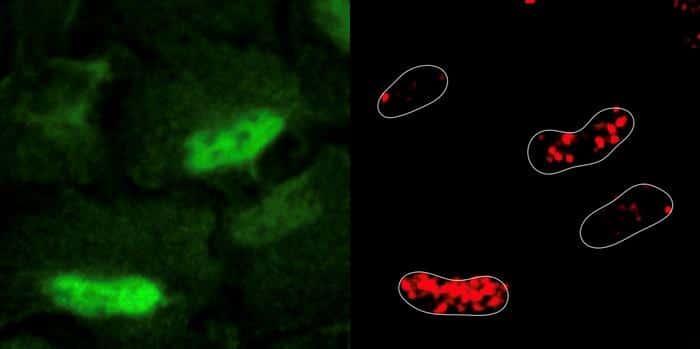
В ходе эксперимента с помощью технологии CRISPR-Cas9 были идентифицированы гены, участвующие в выживании клеток. Затем исследователи обнаружили, что устранение генов, участвующих в клеточном дыхании, делает здоровые клетки устойчивыми к этопозиду. Это означает, что этот препарат, как и другие, действующие по тому же механизму, могут оказывать лишь ограниченное воздействие на опухоли. Это связано с тем, что большинство раковых клеток являются гликолитическими, что означает, что они могут осуществлять свой метаболизм без клеточного дыхания и в присутствии кислорода.
Эти открытия требуют изучения новых противораковых стратегий, таких как сочетание этопозида с молекулами, стимулирующими выработку АФК. Это может помочь преодолеть устойчивость к химиотерапии. Ингибиторы синтеза нуклеотидов также можно использовать для предотвращения репарации ДНК в опухолевых клетках и их самоуничтожения.
Больше интересных статей здесь: Новости науки и техники.
Источник статьи: В случае повреждения ядро клетки вызывает антиоксидантные ферменты для восстановления ДНК и сохранения целостности генома.

