
Исследователи разработали соединение, которое действует как «молекулярный клей» между двумя белками и при объединении активирует естественный процесс самоуничтожения (или апоптоза) в раковых клетках. Что отличает эту стратегию от других методов клеточной терапии, так это ее высокая специфичность и способность активировать молекулярные процессы, инактивированные раком. Соединение показало многообещающие результаты в тестах на диффузных клетках В-клеточной лимфомы.
Каждый день наш организм уничтожает около 60 миллиардов клеток посредством запрограммированного процесса гибели клеток, называемого апоптозом. Этот механизм необходим для естественного обновления клеток, особенно клеток крови и кишечника, и играет ключевую роль во многих биологических процессах, таких как функции органов и регуляция иммунной системы. Он обладает высокой избирательностью, убивая только несущественные клетки и сохраняя те, которые распознают патогены, тем самым предотвращая аутоиммунные заболевания.
Из-за этой специфичности апоптоз вызвал большой интерес в противораковой терапии. Традиционные методы лечения, такие как химиотерапия и радиация, поражают как здоровые, так и раковые клетки, делая их высокотоксичными. Команда Стэнфордского университета предложила инновационную стратегию использования специфичности апоптоза для специфического уничтожения раковых клеток.
«Это именно тот подход, который мы хотим использовать для лечения рака», — объясняет Джеральд Крэбтри, соавтор исследования, опубликованного в журнале , в блоге Стэнфордской медицины. «Мы надеемся воспроизвести эту специфичность, которая сможет убить 60 миллиардов клеток, не вызывая побочного ущерба, гарантируя, что ни одна клетка не будет убита, если она не является подходящей мишенью», — добавил он.
Подход, контрастирующий с традиционной клеточной терапией
Чтобы использовать апоптоз для уничтожения раковых клеток, исследователи разработали небольшие молекулы, называемые индукторами химической близости (CIP). Он действует как молекулярный клей, соединяя две молекулы, которые обычно не связываются друг с другом. Гипотеза команды состоит в том, что CIP может превращать ингибиторы киназы в активаторы эпигенетически подавленных транскрипционных состояний. Другими словами, он активирует молекулярные пути, которые обычно инактивированы в раковых клетках, в отличие от предыдущих подходов, направленных на инактивацию конкретных онкогенных факторов.
«С момента открытия онкогенов исследователи пытались нейтрализовать их в раковых клетках», — сказал соавтор исследования Роман Саротт из Медицинской школы Стэнфордского университета. «Вместо этого мы пытаемся использовать их для активации сигнальных систем, которые могут быть полезны терапевтически».
CIP предназначен для связывания белка BCL6 с протеинкиназой CDK9. BCL6 представляет собой онкогенный белок, который связан с 40–60% случаев диффузной крупноклеточной В-клеточной лимфомы, часто вследствие мутации, сверхэкспрессии или нарушения регуляции.
Обратите внимание: Вскоре наступит эра автономных боевых машин, которые будут убивать себе подобных.
Мутации BCL6 предотвращают апоптоз раковых клеток, связываясь с геном, ответственным за этот процесс, позволяя опухолям размножаться. CDK9 активирует эти гены. CIP связывает эти две молекулы вместе и направляет их к целевому гену. Участник исследования Натанаэль Грей объясняет: «Вы используете элемент, который имеет решающее значение для выживания при раке, чтобы перевернуть ситуацию и уничтожить его.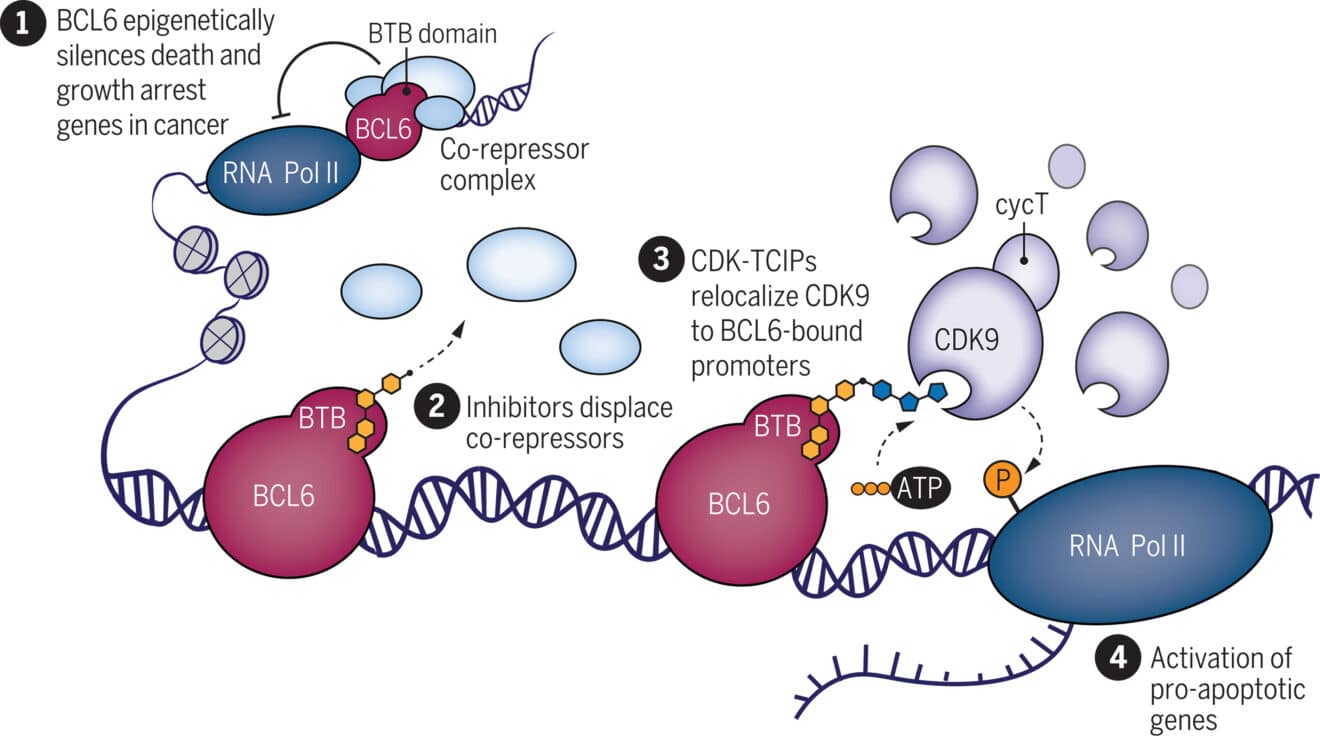
Стократное увеличение эффективности по сравнению с предыдущими методами лечения
Для определения наиболее мощного комплекса CKD9-CIP-BCL6 были протестированы клетки диффузной крупной B-клеточной лимфомы человека. Соединение было протестировано на 859 раковых клетках и показало эффективное разрушение злокачественных клеток. Наиболее мощные комплексы были в 100 раз более эффективны в субнаномолярных концентрациях, чем соединения, нацеленные только на CDK9 или BCL6.
Тесты на здоровых мышах не выявили серьезных побочных эффектов. Однако это соединение также влияет на здоровые В-клетки, поскольку эти иммунные клетки также регулируются BCL6. Исследования показали, что это соединение в 200 раз менее токсично для здоровых В-лимфоцитов, чем для раковых клеток.
Учитывая, что BCL6 регулирует 13 генов, связанных с апоптозом, эксперты полагают, что эта терапия может быть эффективной при лечении резистентного рака. Опухолевые клетки быстро становятся устойчивыми к лечению, направленному на отдельные канцерогены. Некоторые методы лечения могут остановить рост опухоли, но не уничтожают раковые клетки полностью. Команда считает, что если нацелены на несколько путей апоптоза, опухоли могут не выжить достаточно долго, чтобы развить устойчивость, хотя эту гипотезу еще предстоит проверить.
Следующим шагом будет тестирование препарата на мышиных моделях диффузной крупноклеточной В-клеточной лимфомы для сбора доклинических данных для будущих клинических испытаний. Исследователи также планируют изучить другие подобные молекулы, воздействующие на другие онкогенные белки, такие как Ras, который участвует в развитии некоторых видов рака.
Все последние новости здравоохранения и медицины читайте на New-Science.ruБольше интересных статей здесь: Новости науки и техники.

