Представьте себе гигантскую чашу Петри, разделенную на концентрические зоны. Внешние кольца содержат питательную среду без лекарств, но по мере приближения к центру концентрация антибиотика возрастает в десятки, сотни и даже тысячи раз. Ученые наблюдают, как бактерии, размножаясь, упираются в этот химический барьер. Однако эволюция не дремлет: случайная мутация позволяет одной из них преодолеть первую линию обороны. Ее потомки, унаследовав устойчивость, начинают захватывать пространство с более высокой концентрацией яда. Этот процесс повторяется слой за слоем. Барьеры лишь ненадолго сдерживают натиск, и для полного захвата «поля боя» микробам требуется менее двух недель. Этот эксперимент — наглядная демонстрация пугающей скорости, с которой бактерии адаптируются к самым мощным лекарствам.

Перед нами — эволюция в реальном времени. Ученые могут не только наблюдать за процессом, но и секвенировать ДНК бактерий, точно определяя, какая мутация и на каком этапе возникла. Этот опыт ярко иллюстрирует одну из главных проблем современной медицины: стремительное развитие антибиотикорезистентности. Бактерии обладают целым арсеналом механизмов для выработки, закрепления и даже горизонтальной передачи генов устойчивости.
История напоминает нам, какой была жизнь до эры антибиотиков. Банальная инфекция могла стать смертным приговором, а пандемии вроде «Черной смерти» в XIV веке уносили жизни трети населения Европы. Именно антибиотики позволили человечеству забыть о многих смертоносных болезнях, превратив их из ужасающей угрозы в управляемую проблему.
Что же ждет нас, если антибиотики потеряют свою эффективность? Неужели мы откатимся в эпоху, где улицы будут заполнены жертвами инфекций, а самой востребованной профессией станет не IT-специалист, а чумной доктор? Давайте разберемся, насколько реален такой апокалиптический сценарий и что наука противопоставляет этой угрозе.
Открытие и древняя история антибиотиков
В 1928 году Александр Флеминг совершил революционное открытие, заметив, что плесень Penicillium notatum подавляет рост колоний золотистого стафилококка. Выделенное им вещество — пенициллин — стало первым в мире антибиотиком, спасшим миллионы жизней.
Однако сама концепция антимикробной войны не является изобретением человека. Исследования показывают, что гены устойчивости к антибиотикам существовали в бактериальных сообществах более миллиарда лет назад. Эти вещества изначально были «биологическим оружием» в конкурентной борьбе одних микроорганизмов против других. Примечательно, что бактерии-продуценты, как правило, обладают и механизмами самозащиты от собственного же оружия. Таким образом, антибиотики — это природные соединения, а человек не изобретает их, а лишь открывает и адаптирует для своих нужд.
Пятерка самых опасных бактериальных убийц
Чтобы осознать ценность антибиотиков, достаточно вспомнить статистику. В 2019 году бактериальные инфекции стали причиной 13,7 миллионов смертей по всему миру. Среди возбудителей выделяется «великолепная пятерка», ответственная за огромное количество летальных исходов.
1. Золотистый стафилококк (Staphylococcus aureus)
Этот микроб — коварный сосед, обитающий на коже и слизистых большинства людей. При ослаблении иммунитета он превращается в агрессивного патогена, вырабатывающего токсины, разрушающие ткани и клетки крови. Особую опасность представляют штаммы MRSA (метициллин-резистентный золотистый стафилококк), устойчивые к большинству стандартных антибиотиков и способные выживать даже в стерильных условиях операционных.
2. Кишечная палочка (Escherichia coli)
Большинство штаммов E. coli — мирные обитатели кишечника. Однако патогенные разновидности, такие как энтерогеморрагическая кишечная палочка, производят шига-токсин. Он блокирует синтез белка в клетках кишечника и сосудов, приводя к тяжелой диарее, а в осложненных случаях — к почечной недостаточности. Главная профилактика — простая гигиена.
3. Пневмококк (Streptococcus pneumoniae)
Главное оружие этой бактерии — плотная полисахаридная капсула, скрывающая ее от иммунной системы. Пневмококк является частой причиной пневмонии, менингита и отита. Его токсин, пневмолизин, повреждает клетки организма. Широкое распространение устойчивых штаммов делает борьбу с ним особенно сложной.
4. Клебсиелла пневмонии (Klebsiella pneumoniae)
Эта бактерия также использует капсулу для маскировки и умеет формировать биопленки на медицинских имплантатах. Ее главная суперспособность — производство ферментов карбапенемаз, которые разрушают антибиотики «последней линии защиты», оставляя врачей практически безоружными.
5. Синегнойная палочка (Pseudomonas aeruginosa)
Настоящий кошмар реанимаций и ожоговых отделений. Обладает целым набором защитных механизмов: биопленки, эффлюксные насосы для откачки антибиотиков, ферменты для их разрушения и высокая адаптивность. Вырабатывает экзотоксин А, блокирующий синтез белка в клетках человека.
Отдельно стоит упомянуть восходящую звезду антибиотикорезистентности — ацинетобактерию Баумана (Acinetobacter baumannii). Некоторые ее штаммы несут рекордные «островки устойчивости» с десятками генов, делающих ее практически неуязвимой. Смертность от вызываемых ею инфекций в тяжелых случаях достигает 91%.
Бактерии обмениваются генами устойчивости, как игроки карточными фишками. Зачастую эти гены хранятся не в основной хромосоме, а на мобильных плазмидах — кольцевых молекулах ДНК, которые легко копируются и передаются даже между разными видами бактерий.
Как работают антибиотики и как бактерии им сопротивляются
Важнейший принцип действия антибиотиков — избирательная токсичность. Они должны атаковать мишени, уникальные для бактерий и отсутствующие у человека.
Пенициллин и его потомки (β-лактамы) атакуют клеточную стенку бактерий. Молекула пенициллина имитирует «строительный блок» стенки. Ферменты бактерии ошибочно встраивают его в растущую структуру, что приводит к образованию дефектной стенки. При делении клетка просто разрывается под внутренним давлением. Ответ бактерий — производство ферментов β-лактамаз, которые разрушают молекулу антибиотика. В ответ люди создали комбинации вроде амоксициллина с клавулановой кислотой, где кислота служит «приманкой» и нейтрализует защитные ферменты, позволяя антибиотику сделать свою работу.
Тетрациклин действует иначе. Он проникает внутрь бактерии и блокирует ее рибосомы — молекулярные фабрики по производству белка. Ключевая хитрость в том, что бактериальные рибосомы структурно отличаются от человеческих, что позволяет лекарству бить прицельно. Бактерии могут сопротивляться, изменяя структуру рибосом, снижая проницаемость мембраны или активируя насосы для выброса антибиотика наружу.
Мифы и реальность об устойчивости
Существует несколько распространенных заблуждений, которые важно развеять.
Миф 1: Устойчивость возникает только у тех, кто неправильно принимал антибиотики.
Реальность: Гены устойчивости циркулируют в окружающей среде. Их распространению сильно способствует массовое использование антибиотиков в животноводстве. Устойчивые бактерии с ферм могут попасть к человеку через пищу, воду или контакт, а затем передать свои гены патогенам.
Миф 2: Курс антибиотиков всегда нужно пропить до конца, чтобы «добить» всех бактерий.
Реальность: Современные исследования показывают, что для многих инфекций эффективны более короткие курсы. Длительный прием увеличивает время контакта бактерий с препаратом, что может ускорить отбор устойчивых штаммов. Длительность терапии должен определять врач.
Важный момент: устойчивость — это эволюционная «услуга за услугу». Мутации, дающие защиту от антибиотика, часто делают бактерию менее приспособленной в обычных условиях. Они требуют лишних энергозатрат или ухудшают жизненно важные функции. Если убрать давление антибиотика, такие бактерии часто проигрывают в конкуренции своим «диким» сородичам, и доля устойчивых штаммов в популяции может снизиться. Это явление лежит в основе стратегии «циклирования» антибиотиков в медицине.
Новые надежды: поиск следующего поколения антибиотиков
После долгого затишья в фармакологии наметился прогресс. Ученые ищут соединения с принципиально новыми механизмами действия, к которым у бактерий еще нет готовой защиты.
• Лассо-пептиды, такие как лариоцидин. Их молекула напоминает затянутую петлю. Они также атакуют рибосомы, но связываются с новым, неожиданным участком, обходя известные механизмы устойчивости.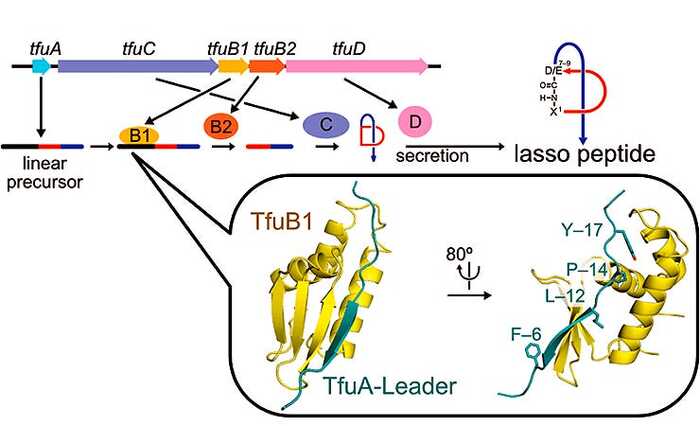
• Гепотидацин — первый за 30 лет новый класс пероральных антибиотиков, одобренный для лечения инфекций мочевыводящих путей. Он блокирует раскручивание ДНК бактерии, но делает это иначе, чем предшественники.
• Крезомицин — полностью синтетический антибиотик, спроектированный с нуля для плотного связывания с рибосомой в уникальной позиции. Это минимизирует риск возникновения устойчивости.
Альтернативные и вспомогательные методы борьбы
Помимо новых лекарств, наука исследует и нестандартные подходы.
Бактериофаги — вирусы, избирательно уничтожающие бактерии. Они безвредны для человека. Хотя массовых фаговых препаратов пока нет, персонализированная фаговая терапия в комбинации с антибиотиками показывает обнадеживающие результаты в лечении устойчивых инфекций.
Трансплантация микробиоты (фекальная трансплантация) — клинически одобренный метод для борьбы с рецидивирующей инфекцией Clostridium difficile. Здоровая микрофлора донора вытесняет патоген. Однако это сложная медицинская процедура, требующая тщательного скрининга донора, и ни в коем случае не домашний эксперимент.
Больницы: фронт борьбы и инкубатор резистентности
Стационары — это эпицентр проблемы. Здесь сосредоточены ослабленные пациенты, мощный поток антибиотиков и разнообразные бактерии, постоянно обменивающиеся генами. Поэтому инвестиции в современные системы вентиляции, регулярную глубокую уборку, УФ-стерилизацию и контроль влажности — это не просто траты, а жизненно важные меры по сдерживанию резистентности. Пренебрежение санитарией, как в случае со вспышкой болезни легионеров в 1976 году, может стоить десятков жизней.
Заключение: стратегия выживания в эпоху супербактерий
Угроза антибиотикорезистентности реальна и растет благодаря базовым законам эволюции. Однако человечество не безоружно. Наша стратегия должна быть комплексной:
1. Разумное использование: Принимать антибиотики только по назначению врача, никогда — «для профилактики» или при вирусных инфекциях.
2. Контроль в сельском хозяйстве: Жестко ограничивать применение антибиотиков как стимуляторов роста животных.
3. Инвестиции в науку: Поддерживать разработку новых классов антибиотиков и альтернативных методов.
4. Бескомпромиссная гигиена: Особенно в медицинских учреждениях.
5. Вакцинация: Это мощнейший инструмент профилактики. Предотвращая болезнь, мы избегаем необходимости применять антибиотики.
Бактерии будут эволюционировать, чтобы выжить. Это естественно. Задача человечества — постоянно оставаться на шаг впереди, используя научные знания и здравый смысл. Только так мы сможем выиграть эту бесконечную гонку вооружений и не вернуться в медицинское средневековье.
Подписывайтесь на соц. сети:
Бусти / Патреон / Instagram / Telegram / Youtube / TikTok
Мой авторский цикл лекций
Как проверять информацию
Еду в осенний тур с лекцией «Радикальное продление жизни»
Билеты и подробности — здесь.
Источники
https://docs.google.com/document/d/e/2PACX-1vQ_LaDnOqneWn5IOnRN5HZ3ibCnNx2iWzRn2_Foc3Y9Kr2PVrpOb4d6cldhK1ZYaNWdeQTVJO-y2rb1/pub
Больше интересных статей здесь: Производство.
Источник статьи: Мы все умрем: что наука знает об устойчивости к антибиотикам.

