
Учёные создали уникальное соединение, выполняющее роль «молекулярного клея». Его задача — связать два ключевых белка, что в итоге запускает в раковых клетках механизм запрограммированной гибели, или апоптоза. Главное преимущество этого подхода — высокая избирательность и способность реактивировать молекулярные пути, которые рак обычно блокирует. Первые испытания на клетках диффузной В-клеточной лимфомы показали обнадёживающие результаты.
Ежедневно в нашем организме естественным образом погибает около 60 миллиардов клеток благодаря апоптозу. Этот процесс критически важен для обновления тканей, особенно в крови и кишечнике, а также для правильной работы органов и иммунной системы. Его избирательность поразительна: он устраняет только ненужные или потенциально опасные клетки, не затрагивая здоровые, что предотвращает развитие аутоиммунных реакций.
Именно эта природная точность делает апоптоз столь привлекательной мишенью для противораковой терапии. В отличие от агрессивных методов вроде химио- и лучевой терапии, которые повреждают и здоровые ткани, новая стратегия стремится использовать внутренние механизмы клетки против неё самой. Команда из Стэнфордского университета предложила инновационный путь.
«Это именно тот подход, который мы хотим использовать для лечения рака», — поясняет соавтор исследования Джеральд Крэбтри в блоге Стэнфордской медицины. Результаты работы опубликованы в журнале Science. «Мы надеемся воспроизвести ту самую специфичность, которая позволяет организму уничтожать десятки миллиардов клеток без побочного ущерба, гарантируя, что гибнут только строго определённые цели», — добавил учёный.
Новый вектор в клеточной терапии
Для реализации этой идеи исследователи разработали особые малые молекулы — индукторы химической близости (CIP). Они работают как молекулярный клей, соединяя белки, которые в норме не взаимодействуют. Учёные выдвинули гипотезу, что CIP могут превращать ингибиторы киназ в активаторы эпигенетически «замолчанных» транскрипционных программ. Проще говоря, они не блокируют онкогены, а, наоборот, используют их для включения полезных с терапевтической точки зрения процессов, которые раковая клетка подавила.
«С момента открытия онкогенов учёные в основном пытались их нейтрализовать в раковых клетках, — говорит соавтор работы Роман Саротт из Медицинской школы Стэнфорда. — Мы же идём от обратного: пытаемся задействовать онкогены для активации сигнальных систем, которые могут принести терапевтическую пользу».
Конкретная мишень для CIP — связка белка BCL6 с протеинкиназой CDK9. BCL6 — онкогенный белок, играющий ключевую роль в развитии 40–60% случаев диффузной крупноклеточной В-клеточной лимфомы.
Обратите внимание: Вскоре наступит эра автономных боевых машин, которые будут убивать себе подобных.
Мутации в BCL6 позволяют раковым клеткам избегать апоптоза, связываясь с генами, ответственными за этот процесс, и давая опухоли возможность бесконтрольно расти. CDK9, в свою очередь, способна активировать эти гены. CIP, склеивая BCL6 и CDK9, направляет их к нужному генетическому участку. «Вы используете элемент, критически важный для выживания рака, чтобы развернуть ситуацию против него самого и уничтожить его», — объясняет участник исследования Натанаэль Грей.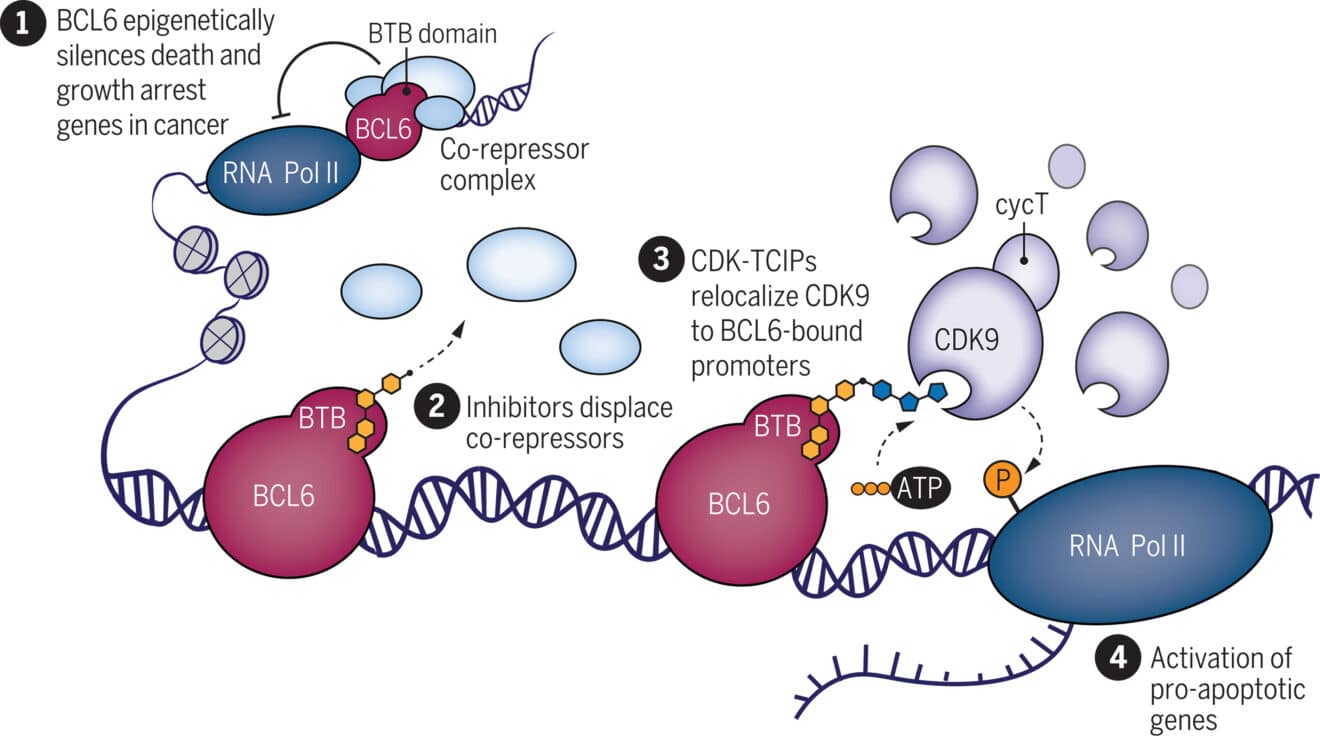
Схема, иллюстрирующая механизм действия молекулярного клея. Транскрипционный фактор BCL6 взаимодействует с эпигенетическими корепрессорами, регулируя гибель и пролиферацию клеток при лимфоме. Образующаяся двухвалентная молекула перенаправляет CDK9 и его активность на сайты, регулируемые BCL6, тем самым активируя гибель клеток.
Стократное превосходство в эффективности
Учёные провели скрининг, чтобы найти наиболее мощную комбинацию CKD9-CIP-BCL6, тестируя её на клетках диффузной крупной B-клеточной лимфомы человека. Соединение показало высокую эффективность против злокачественных клеток в панели из 859 раковых линий. Наиболее действенные комплексы оказались в 100 раз эффективнее в субнаномолярных концентрациях, чем вещества, нацеленные только на CDK9 или только на BCL6 по отдельности.
Испытания на здоровых мышах не выявили серьёзных побочных эффектов. Однако соединение всё же влияет на здоровые В-клетки, поскольку их работа также регулируется белком BCL6. Важно, что исследования показали: для здоровых В-лимфоцитов соединение примерно в 200 раз менее токсично, чем для раковых клеток, что говорит о хорошей избирательности.
Поскольку BCL6 регулирует целых 13 генов, связанных с апоптозом, эксперты полагают, что такая терапия может быть особенно эффективной против устойчивых форм рака. Опухоли часто быстро развивают резистентность к препаратам, нацеленным на один-единственный онкоген. Многие существующие методы лишь останавливают рост опухоли, но не убивают её полностью. Учёные надеются, что одновременная активация нескольких путей апоптоза не оставит раковым клеткам времени для выработки устойчивости, хотя эту гипотезу ещё предстоит тщательно проверить.
Следующий этап — испытания препарата на мышиных моделях диффузной крупноклеточной В-клеточной лимфомы для сбора необходимых доклинических данных перед переходом к клиническим исследованиям на людях. Параллельно команда планирует изучить возможность создания аналогичных «молекулярных клеев» для воздействия на другие онкогенные белки, например, Ras, который участвует в развитии многих видов рака.
Все последние новости здравоохранения и медицины читайте на New-Science.ru
Больше интересных статей здесь: Новости науки и техники.
Источник статьи: Исследователи разработали соединение, которое действует как «молекулярный клей» для двух белков, которые, соединяясь, активируют естественный процесс самоуничтожения (или апоптоз) в раковых клетках.

